ب به صورت برگشت پذیر ولی به مقدار خیلی کم یونیزه می شود. تجزیه آب به صورت ![]() آنقدر کم است که در دمای اتاق در هر لیتر آب مقطر فقط ۷-۱۰مول +H با همین مقدار –OH در حال تعادل است. یعنی یک مولکول از هر ۵۵۵۰۰۰۰۰۰ ( ۱۰۸ × ۵۵/۵ ) مولکول آب به +H و –OH تجزیه می شود ولیکن بسیاری از ویژگی آب از همین مقدار کم یونیزاسیون ناشی می شود.
آنقدر کم است که در دمای اتاق در هر لیتر آب مقطر فقط ۷-۱۰مول +H با همین مقدار –OH در حال تعادل است. یعنی یک مولکول از هر ۵۵۵۰۰۰۰۰۰ ( ۱۰۸ × ۵۵/۵ ) مولکول آب به +H و –OH تجزیه می شود ولیکن بسیاری از ویژگی آب از همین مقدار کم یونیزاسیون ناشی می شود.
حاصلضرب یونی آب KW چنین تعریف می شود. ![]()
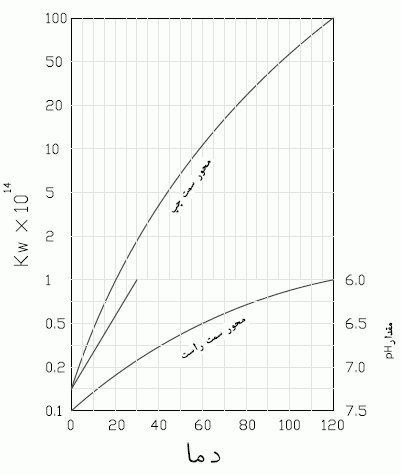
مقدار Kw بستگی به دما دارد که در شکل زیر نشان داده شده است. رابطه فوق همواره صادق است و به ناخالصی های آب بستگی ندارد. قدرت اسید هر محیط آبی توسط PH بیان می شود که چنین تعریف می شود:
![]()
امروزه به سهولت با دستگاه pH متر امکان پذیر است. اما نباید فراموش کرد که هیچ آنالیزی بدون معلون کردن pH کامل نخواهد بود و نیز توجه داشته باشید که pH به دما بستگی دارد.
» قلیاییت آب
قلیایت آب نمایانگر ظرفیت آب برای خنثی کردن اسید افزوده شده و تا رسیدن به pH حدود ۵/۴ است. هرچه قلیاییت آب بیشتر باشد ظرفیت بافری آن بیشتر است. بنابراین دانستن قلیاییت آب مکمل دانستن pH آب می باشد، چون pH آب معرف قدرت اسیدی آب بوده ولی قلیاییت آب معرف مقاومت آب در برابر تغییرات pH است. آبی که حاوی ۱ppm گاز Co2 و ۱۰ppm قلیاییت باشد دارای همان PH آبی است که حاوی ۱۰ppm گاز Co2 و ۱۰۰ppm قلیاییت است. اما اگر به آب اولی ۴ppm از گاز Co2 اضافه کنیم PH آن کاملا تغییر می کند ولی اگر به آب دومی همان مقدار گاز CO2 اضافه کنیم، تغییر PH آن قابل توجه نیست و این معرف نقش قلیاییت در تولید محیط بافری در آب می باشد. قلیاییت آب طبیعی معمولا برابر مجموع غلظت یون های بی کربنات، کربنات و هیدروکسیل است. غلظت آنیون های دیگر چون فسفات یا سیلیکات در مقایسه با غلظت این سه یون قابل صرفنظر کردن هستند. در تصفیه آب نه فقط دانستن مجموع غلظت آنیون های تشکیل دهنده قلیاییت مهم است بلکه دانستن غلظت هر یک از آنیون ها هم مهم است. از این رو با اندازه گیری دو نوع قلیاییت، غلظت هر یک از سه آنیون تشکیل دهنده قلیاییت مشخص می شود.دو نوع قلیاییت عبارتند از:
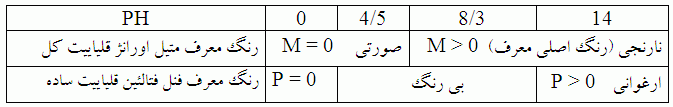
۱-قلیاییت ساده یا قلیاییت نسبت به فنل فنالئن P
۲ – قلیاییت کل یا قلیاییت نسبت به متیل اورانژ M
روش اندازه گیری قلیاییت
محلول های لازم برای آزمایش: ۱- محلول۰۲/۰ N سولفوریک اسید. ۲- معرف فنل فتالئین و متیل اورانژ
برای اندازه گیری قلیاییت، ۱۰۰cc از نمونه مورد نظر را در یک ارلن مایر ۵۰۰cc و ۳ تا ۴ قطره معرف فنل فتالئین بدان اضافه کنید. در صورتی که محلول ارغوانی شود، قلیاییت دارد و در غیر این صورت قلیاییت ندارد. اگر محلول ارغوانی شود پس از ریختن به اندازه کافی سولفوریک اسید، رنگ ارغوانی از بین خواهد رفت که PH محلول در این شرایط ۸/۳ خواهد شد.
هر سانتیمتر مکعب از سولفوریک اسید مصرف شده معرف ۱۰ppm قلیاییت ساده و بر حسب ( معادل کربنات کلسیم ) است. واکنش های انجام شده تا این مرحله به صورت زیر است.
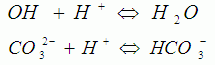
اگر بخواهیم قلیاییت کل را پیدا کنیم باید در حضور معرف متیل اورانژ به تیتراسیون ادامه دهیم تا رنگ زرد پرتقالی (پوست پیازی) ظاهر شود PH در این نقطه حدود ۵/۴ می باشد. کل اسید مصرف شده از ابتدا تا PH حدود ۵/۴ را در ۱۰ ضرب کرده تا قلیاییت کل پیدا شود. در محدوده قلیاییت کل ( که شامل محدوده قلیاییت ساده هم می شود ) واکنش های زیر انجام می شود.
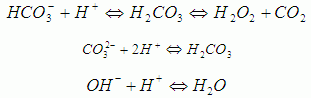
جدول زیر می تواند به درک بهتر مفهوم دو نوع قلیاییت کمک کند.
توجه کنید که در تصفیه آب PH برابر ۷ به مفهوم PH سرنوشت ساز مطرح نیست. در واقع PH حدود ۵/۴ در تصفیه آب نقش مهمتری از PH برابر ۷ دارد چون معرف عدم وجود قلیاییت در آب است. می توان از فرمول زیر برای محاسبه قلیاییت آب استفاده کرد.
![]()
که در آن V حجم اسید مصرف شده با نرمالیته N است و Wحجم آب نمونه است.
» یادآوری این نکته مهم است که PH مطلوب آب دیگ بخار ۱۱ الی ۸/۱۱ می باشد. جهت دریافت اطلاعات بیشتر در مورد این مقاله و کیفیت آب بویلر با شماره تلفن ۰۹۱۲۶۲۷۱۳۸۱ تماس حاصل فرمایید.


شما باید وارد شده برای ارسال نظر.